2020年ASCO大会虽然改为网络在线举行,但并没有降低广大医务工作者学习交流医学信息及新药研发进展的热情。中国生物医药公司作为全球新药研发版图中越来越重要的组成部分,在2020 ASCO大会上带来了小分子靶向治疗、免疫疗法、ADC治疗、细胞治疗等领域的诸多令人印象深刻的进展。
基石药业是近两年在国内快速崛起的生物医药企业,不仅以自主研发+license in双轮驱动的方式打造了富有竞争力的肿瘤药物产品管线,还在创立不满3年时间成功IPO,跻身于国内领先生物医药公司的队伍。随着产品临床开发的稳步推进,基石药业正处于从研发阶段向商业阶段升级转型的关键时期,因此其管线中核心产品的临床数据得到业内越来越多的关注。
基石药业产品管线
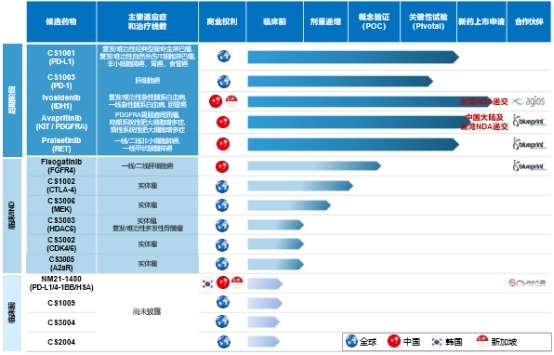
来源:基石药业
在此次2020 ASCO大会上,基石药业及其合作伙伴分享了CS1001(PD-L1单抗)、avapritinib(KIT PDGFRA抑制剂)、pralsetinib(RET抑制剂)等3款处于后期阶段新药的关键临床数据,让大家对基石药业产品的未来商业化前景有了更进一步的认知。
CS1001:一线治疗晚期非小细胞肺癌III期结果值得期待
CS1001由基石自主研发,是基于美国Ligand公司授权引进的OmniRat®转基因动物平台发现的一种全人源全长抗PD-L1单克隆抗体,是一种最接近人体天然IgG4的单抗药物,相比同类药物具有免疫原性及相关毒性风险更低的安全性优势。基石药业在2020 ASCO大会上公布了CS1001-101研究的晚期非小细胞肺癌(NSCLC)队列Ib期研究的关键概念性验证(POC)数据。
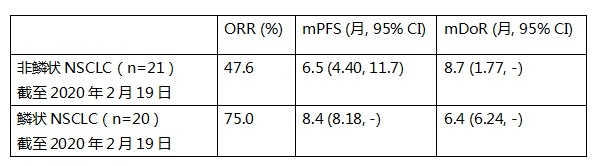
非鳞状NSCLC队列入组21例患者,截至2020年2月19日,有10例患者实现部分缓解(PR),客观缓解率(ORR)为47.6%,中位无进展生存期(mPFS)为6.5个月,中位应答持续时间(DoR)为8.7个月。
鳞状NSCLC队列入组20例患者,截至2020年2月19日,ORR达到了75%,中位PFS为8.4个月,中位DoR为6.4个月。
安全性方面,CS1001耐受性良好,未发生因CS1001治疗相关不良事件导致患者退出的病例。截至2019年7月1日,非鳞状NSCLC队列药物治疗相关不良事件(TRAE)发生率为85.7%(18/21),3级以上TRAE发生率28.6%(6/21)。免疫相关不良反应(irAE)发生率为23.8%(5/21),均为2级,其中天门冬氨酸转氨酶(AST)升高4例,丙氨酸转氨酶(ALT)升高3例。鳞状NSCLC患者队列TRAE发生率90.0%(18/20),3级以上TRAE发生率25%(5/20)。irAE发生率15%(3/20),包括2级以下皮疹2例。
总体而言,CS1001在同时包含非鳞状和鳞状NSCLC的Ib期研究中显示了出色的抗肿瘤活性和良好的安全性数据,特别是对于鳞状NSCLC高达75%的ORR几乎是同类产品在I期阶段的最好成绩 ,也提示CS1001有望在样本放大的III期研究中取得理想的疗效数据。
基石药业目前已经完成了CS1001联合含铂化疗 vs 安慰剂联合化疗一线治疗晚期 NSCLC的III期研究的患者招募,入组480例患者,预计会在几个月后公布主要研究结果。 这是中国首个同时涵盖鳞状NSCLC和非鳞NSCLC两种亚型患者的PD-1/PD-L1一线疗法III期临床研究,结果值得期待。
肺癌在全球和中国均是发病率和死亡率最高的癌种,中国2018年大约有77万新增肺癌病例,69万肺癌死亡病例。肺癌向来都是肿瘤药市场的必争之地,一线疗法更是肺癌市场竞争的制高点。NSCLC(占肺癌的85%)中非鳞状占大约70%,鳞状占大约30%。基石药业若能在完成III期研究后同时提交涵盖鳞状和非鳞NSCLC的上市申请 ,必将会在市场中处于有利的竞争地位。
Pralsetinib:攻克RET阳性实体瘤利器
Pralsetinib是Blueprint Medicines 公司开发的一款高选择性RET(rearranged during transfection)单一靶点抑制剂。基石药业在2018年6月与Blueprint Medicines达成合作,引进了pralsetinib的大中华区开发权益。此前,Blueprint Medicines已经向FDA和EMA提交了pralsetinib治疗RET融合阳性的局部晚期或转移性NSCLC的上市申请。基石药业于2019年8月完成了pralsetinib全球I期研究的中国地区首例患者给药,预计2020年 第三季度在中国提交上市申请。
RET是位于10号染色体上的一个原癌基因,其编码的RET蛋白是一种存在于细胞膜上的受体酪氨酸激酶。当生长因子与RET的胞外区域结合后,就会触发一系列细胞内的链式化学反应,引起细胞的分裂、成熟并发挥相应功能。RET融合阳性癌症和RET突变阳性甲状腺髓样癌的肿瘤细胞分化和增殖高度依赖于RET蛋白的激活,这种依赖性通常也被称为“致癌基因成瘾”,因此RET阳性肿瘤对高选择型的单靶点RET抑制剂非常敏感。RET基因融合在NSCLC患者中的发生率约为1%~2%,在甲状腺乳头状癌(占所有甲状腺癌的85%左右)中的发生率为10%~20%。RET基因突变在甲状腺髓样癌中的发生率为60%左右。
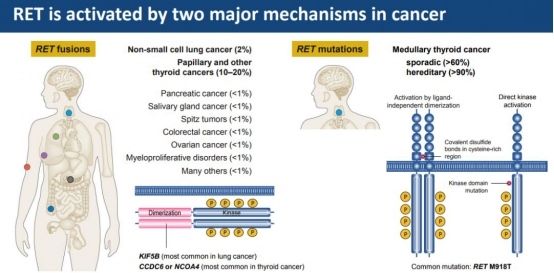
Blueprint Medicines此次在2020 ASCO大会上公布的pralsetinib最新数据来自临床缓解可评估分析集,包括116例RET基因融合阳性NSCLC患者、11例RET基因融合阳性甲状腺癌患者、12例其他肿瘤类型的RET基因融合阳性患者。
截至2019年11月18日,80例既往接受过含铂化疗的RET融合阳性NSCLC患者经pralsetinib治疗的ORR为61%(95%CI :50-72) ,其中2例PR在数据截至日时待确认但在随后得到了确认。5%的患者实现了经确认的CR,14%的患者实现了靶病灶肿瘤的完全消退。26例未接受过系统治疗的R ET 融合阳性患者经 pralsetinib 治疗的ORR为73%(95% CI: 52-88),CR为 12%。
对于9例基线时存在可评估脑转移病灶的NSCLC患者, pralsetinib也显示出了强劲而持久的颅内抗肿瘤活性。9例患者均出现了CNS转移病灶缩小,颅内完全缓解的患者比例为33%(3/9) ,CNS出现缓解的患者未出现任何CNS进展事件,CNS缓解的中位 DOR尚未达到。截至数据截止日,存在可评估脑部转移病灶的患者治疗持续时间均长达12个月,基线时无CNS转移的患者均未发现新的CNS转移病灶。
总之,pralsetinib对RET融合阳性NSCLC患者中表现出了疗效一致且优异的临床抗肿瘤活性,无论患者是否曾经接受过治疗,也无论患者的RET融合伴侣类型或是否已累及CNS。对于上述116例RET融合阳性NSCLC患者,实现缓解患者的中位DOR均未到达(95%CI:11个月~未达到),DOR达到6个月的患者比例为86%。截至数据截止,已确认缓解的患者(包括所有CR的患者)有74%仍在治疗中。
对于其它类型的RET融合阳性肿瘤患者,pralsetinib也均显示出显著的临床活性。截至2020年2月13日,在11例RET融合阳性甲状腺癌患者中(10例曾接受过全身治疗),经确认的ORR为91%(95% CI :59-100),疾病控制率为100 %(95% CI:72-100) ,有70%的缓解患者仍在接受治疗,治疗持续时间目前长达22个月。在之前接受过全身治疗的12例其他RET 融合阳性肿瘤患者中,研究者评估的ORR为50%( 95% CI:21‒79) ,其中有1例PR待确认。在所有可评估的胰腺癌(n = 3)和胆管癌(n = 2)患者中均观察到不同程度的缓解,这些类型的肿瘤通常预后较差。
安全性方面, 截至2019年11月18日,共有354例患者参加了ARROW临床试验,并以400 mg每日1次的起始剂量接受pralsetinib治疗。Pralsetinib的整体安全性结果与先前报告的数据结果一致。Pralsetinib在各瘤种中均显示出了良好的耐受性,TRAE多数为1/2级。研究者报告的最常见(≥15%)TRAE包括AST升高、贫血、ALT升高、便秘、高血压和中性粒细胞减少症。研究者报告的≥5%的3级或以上TRAE包括高血压、中性粒细胞减少症和贫血。只有4%的患者因为TRAE终止了pralsetinib治疗 。
目前对于RET融合突变肿瘤的治疗方案主要是使用多激酶抑制剂类药物,比如卡博替尼、凡德他尼,由于靶向选择性不高,疗效非常有限且毒性较大。由以上数据可以发现,pralsetinib不仅可以为RET阳性实体瘤患者带来强劲而稳定的疗效,而且3级以上不良事件发生率低,生存获益非常显著。
Pralsetinib被FDA授予了治疗经含铂化疗后进展的RET融合NSCLC以及需要系统治疗且没有可替代治疗方案的RET突变阳性甲状腺髓样癌的突破性疗法资格,获批之后将为这类患者提供一个新的治疗选择。虽然RET基因融合阳性患者在NSCLC中的占比远不如EGFR突变高,但肺癌人群的庞大基数和RET单一靶点抑制剂的确切临床获益决定了RET抑制剂良好的市场潜力。
Avapritinib:打破晚期胃肠道间质瘤患者无药可用窘境
Avapritinib是由Blueprint Medicines 公司开发的一款KIT/PDGFRA抑制剂,基石药业在2018年6月与Blueprint Medicines达成合作,引进了avapritinib的大中华区开发权益。2020年1月9日,avapritinib被FDA批准上市,用于治疗携带PDGFRA18外显子突变(包括最常见的D842V 位点突变)的不可手术或转移性成人胃肠道间质瘤(GIST)患者。4月23日,基石药业在中国大陆提交了avapritinib的上市申请,用于治疗携带PDGFRA 外显子18突变(包括D842V突变)的不可手术切除或转移性GIST成人患者,以及四线治疗不可手术切除或转移性GIST成人患者。
FDA批准avapritinib主要基于NAVIGATOR研究的数据。此次2020 ASCO大会上,基石药业公布的是avapritinib在中国GIST患者中开展的桥接试验结果。这项开放标签、多中心、I/II 期临床研究入组的是既往接受过伊马替尼和1种以上其他酪氨酸激酶抑制剂治疗后出现进展或对标准治疗不耐受或携带PDGFRAD842V突变的不可切除或转移性GIST成人患者,主要评估avapritinib的安全性、药代动力学特征和抗肿瘤疗效。
截至2019年12月25日,有12例中国GIST患者完成I期剂量爬坡研究,初步结果显示:
不可切除或转移性晚期中国GIST患者对avapritinib 200mg和300mg具有良好的耐受性,未观察到剂量限制性毒性。安全数据与之前公布的全球研究安全结果一致,无4-5级不良事件(AE)报告,无药物相关的治疗中止事件,最常见的3级TRAE为贫血(n=2);
Avapritinib 吸收迅速,中位达峰时间 2.0-4.0小时,且在稳态下暴露量随剂量成比例增加。avapritinib的平均半衰期为42.2-44.4小时,支持每日一次给药;
Avapritinib在携带PDGFRA D842V 突变的中国GIST患者中初步显示出了良好的抗肿瘤活性。截至2019年12月25日,3例携带D842V突变的患者中有2例实现了部分缓解,另外1例疾病稳定。
以上研究数据初步证明avapritinib对携带 PDGFRA D842V 突变的中国患者具有明显的抗肿瘤活性,支持在中国GIST患者中进一步开展avapritinib的临床研究。基石药业也基于avapritinib在中国患者桥接试验中的安全性特征和 NAVIGATOR 研究的剂量选择结果,最终确定将每日给药一次,每次给药300mg作为中国患者II期临床研究的推荐剂量方案。
GIST是一种罕见肿瘤,美国每年约5000例新确诊患者,中国每年约有3万例新确诊患者。GIST患者中大约80%存在KIT基因突变,大约8%存在PDGFRA D842V突变。中国GIST患者对当前上市的靶向疗法均不敏感,缺少有效治疗药物,avapritinib是FDA批准的首个针对GIST 患者PDGFRA外显子18突变的精准靶向治疗药物,也有望成为中国GIST患者的一种治疗新选择。特别是对于接受过3线以上治疗的GIST患者,更是面临无药可用的局面。这类患者疾病进展快,生存期短,临床需求未得到满足,avapritinib将帮助打破这种临床治疗窘境。
结语
从实验室走向市场,雄厚的研发实力和强大的商业化能力缺一不可。2019年8月,基石药业全球研发总部及生产基地在苏州工业园区正式落户,设计产能为生物制药26000L、小分子化学药10亿片的规模,目前项目已经开工。同时,基石药业已经快速组建了一支商业化团队,核心人员阵容强大,未来随着产品的加速上市,商业化能力也将得到快速升级。
此外,基石药业还在不断探索更多的战略合作,以实现药物在中国市场的价值最大化。与一些企业的外部合作、商业开发屡遭障碍不同,基石药业通过打造“合作产品+自有产品”双轮驱动的模式,为全面商业化奠定了坚实基础。
成功的商业化也离不开资本的支持,公司2019年在香港的IPO在当时的资本市场环境中创下多项纪录,募集资金也成功推动了基石药业业务能力的提升,将基石药业带上了一条快速发展的道路。
2020年将是基石药业加速商业化转型,成为领先的肿瘤精准免疫治疗公司厚积薄发的一年,让我们拭目以待!


 尼尔森IQ发布NIQ BASES 2024年中国突破性创新榜单
尼尔森IQ发布NIQ BASES 2024年中国突破性创新榜单 中国首家“藻饮”店亮相北京,引领健康饮品新风尚
中国首家“藻饮”店亮相北京,引领健康饮品新风尚 捐资100万!天草药业集团助力广州中医药大学高水平建设!
捐资100万!天草药业集团助力广州中医药大学高水平建设! 葡萄酒与文化:Winol酒庄8Lgends系列葡萄酒成为庆祝和艺术的象征
葡萄酒与文化:Winol酒庄8Lgends系列葡萄酒成为庆祝和艺术的象征
